-
Producten
-
Laboratoriuminstrumenten
Overige instrumenten Titratie
-
Laboratoriummeters en -elektroden
Kalibratiestandaarden Overige meters
- Chemie, reagentia en standaarden
-
Online Analysers
Ammoniumanalysers Chlooranalysers
- CL17sc
- CL10 sc Amperometrisch
- 9184 sc Amperometrisch
- Ultra Low Range CL17sc colorimetrische chlooranalyser
Fosfaatanalysers- NP6000sc
- FX610/FX620 systeem
- Filtrax systeem
- 5500 sc
- NP6000sc Chemistry/Reagents
- Phosphax Sigma
- Phosphax sc
- Phosphax sc LR
Silica-analysers TOC- B3500ul
- B3500c
- B3500dw
- B3500e
- B3500s
- B7000i
- B7000i Dairy
- B7000 TOC TN TP
- BioTector Service Onderdelen
EZ Series-analysers- IJzer
- Aluminium
- Mangaan
- Fosfaat
- Chloride
- Cyanide
- Fluoride
- Sulfaat
- Sulfide
- Arsenicum
- Chroom
- Koper
- Nikkel
- Zink
- Ammonium
- Totaal stikstof
- Totaal fosfor
- Fenol
- Vluchtige vetzuren
- Alkaliniteit
- ATP
- Hardheid
- Toxiciteit
- Monsterconditionering
- Borium
- Kleur
- Nitraat
- Nitriet
- Silica
- Waterstofperoxide
- EZ Series Reagents
- EZ Series Accessories
- EZ sc-serie anorganische stoffen
- EZ sc-serie metalen
- EZ sc-serie nutriënten
- Claros Water Intelligence System
-
Online sensoren en controllers
Digitale controllers (transmitters) Controllers (analoog)
- SC4500
- Orbisphere 366x Ex
- Orbisphere 410/510 Koolstofdioxide
- Orbisphere 410/510 Ozon
- Orbisphere 410/510 Zuurstof
- Orbisphere 51x Waterstof
pH- en Redox-sensoren- 1200-S Redox
- 1200-S pH
- 12mm pH/Redox
- 8362 sc Hoge Zuiverheid
- Combinatie pH/Redox
- Differentiële pH
- Digitale Differentiële Redox
- Digitale Differentiële pH
- LCP Redox
- LCP pH
Geleidbaarheidssensoren- 3400 Analoge Contact
- 3400 Digitale Contact
- 3700 Analoge Inductieve
- 3700 Digitale Inductieve
- 3798 sc Electrodeloos
- 9523 kationische geleidbaarheid
- Geautomatiseerde laboratoriumsystemen
- Monstername
-
Laboratoriumapparatuur en -voorziening
Algemene labverbruiksmaterialen ApparatuurBoeken en referentiemateriaal Glaswaren/plasticwarenInstrumenten
-
Microbiologie
Accessoires en chemicaliën Gedehydrateerde mediaInstrumenten LaboratoriumbenodigdhedenSets
- Testsets en -strips
- Elektrochemie
-
Laboratoriuminstrumenten
- PARAMETERS
-
Softwareoplossingen
-
Claros waterinformatiesysteem
Productpijlers <a" class="topFamily primaryLink" href="/cms/static/marketing/claros/claros-process-management-18-nl" style="text-transform: none;">Process Management
- Oplossingen voor:
- BZV-/CZV-verwijdering
- Nitrificatie/denitrificatie
- Fosfaatverwijdering
- Slibmanagement
Data Management- Oplossingen voor:
- Verzamelen van data
- Visualisatie en analyse
- Rapportage
- Nauwkeurigheid van gegevens
Instrument Management- Oplossingen voor:
- Onderhoud
- Probleemoplossing
- Toegang op afstand
- Vergelijking tussen lab en proces
Uitdagingen in de industrie Naleving van regelgeving Kostenbesparingen Processen op afstand Data Management Procesoptimalisatie Onderhoud van apparatuur
-
Claros waterinformatiesysteem
- Industrie
- Service
- Nieuws en Evenementen
België
Kies uw land of regio:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
- Vietnam
Middle East - Africa
Ammoniac et ammonium
Qu'est-ce que l'ammoniac ?
L'ammoniac est un composé gazeux d'hydrogène et d'azote (un atome d'azote et trois atomes d'hydrogène, NH 3), incolore et irritant, hautement soluble dans l'eau.
L'ammoniac se forme naturellement comme produit de la décomposition microbiologique de la matière organique azotée (protéines animales et végétales). Il peut également être produit pour être utilisé dans les engrais ou pour la production de plastiques, de produits pharmaceutiques et d'autres produits chimiques.
La présence d'ammoniac dans les eaux souterraines est normale en raison des processus microbiologiques. Cependant, la présence d'azote ammoniacal dans les eaux de surface indique généralement une pollution domestique. Un excès d'ammoniac peut endommager la végétation et est extrêmement toxique pour la vie aquatique, surtout à des niveaux élevés de pH et de température.
Ammoniac aqueux
Pour différentes applications, l'ammoniac est dissous dans l'eau pour produire de l'« ammoniac aqueux ». Les solutions aqueuses d'ammoniac en vrac (ammoniac aqueux) sont instables et la concentration d'ammoniac peut diminuer pendant le transport ou le stockage. Par conséquent, les solutions livrées sont facturées en fonction de la concentration d'ammoniac fournie à l'installation ou à l'utilisateur final.
Qu'est-ce que l'ammonium ?
L'ammonium est un composé contenant un atome d'azote et quatre atomes d'hydrogène (NH 4 +). L'ammoniac est une molécule neutre non ionisée (base faible), tandis que l'ammonium est un ion transportant une charge positive. De plus, l'ammoniac dégage une forte odeur, tandis que l'ammonium est inodore.
Le pH est le principal facteur qui détermine la proportion d'ammoniac par rapport à l'ammonium dans l'eau. L'activité de l'ammoniac est également influencée par la concentration ionique et la température de la solution. Il est important de rappeler que l'ammoniac moléculaire peut être nocif pour les organismes aquatiques, alors que l'ion d'ammonium est fondamentalement inoffensif. Dans l'industrie de l'eau, il est important de connaître les concentrations d'azote lié à l'hydrogène. Par conséquent, les termes ammoniac et ammonium sont utilisés indifféremment, représentés par NH 3 -N ou NH 4 -N en conséquence, et généralement exprimés en mg/L ou PPM de N.
L'équation chimique qui détermine la relation entre l'ammoniac et l'ammonium est la suivante :
NH 3 + H 2O <-> NH 4 + + OH -
Lorsque le pH est faible, l'équilibre tend vers la droite, et lorsque le pH est élevé, l'équilibre tend vers la gauche. En général, à température ambiante avec un pH inférieur à 6, la portion d'ammoniac-N sous forme de NH 3 est très faible et presque tout l'azote ammoniacal est présent sous forme de NH 4 +. Avec un pH de 8 environ, la proportion sous forme de NH 3 est de 10 pour cent ou moins, et avec un pH légèrement supérieur à 9, la proportion est d'environ 50 pour cent. Une fois que le pH est > 11, tous les ions ammonium dans la solution seront convertis en ammoniac sous sa forme moléculaire. L'activité de l'ammoniac aqueux est beaucoup plus faible à basses températures.
Pourquoi surveiller l'ammoniac ?
L'ammoniac est utilisé à la fois comme réactif et comme paramètre de mesure dans plusieurs domaines du traitement de l'eau et des eaux usées.
- Le niveau d'ammoniac naturel est surveillé dans l'eau de source.
- Pendant le processus de désinfection par chloration, l'ammoniac est combiné au chlore pour traiter l'eau potable et maintenir un résidu plus durable dans les systèmes de distribution.
- Parfois, l'ammoniac est utilisé pour le contrôle du pH, comme dans l'industrie pharmaceutique.
- Le niveau d'ammoniac est surveillé de près dans les processus de nitrification et de dénitrification des eaux usées.
Bien que l'ammoniac soit généralement inoffensif à faible concentration, des concentrations élevées peuvent causer des dommages et poser des risques pour la santé. Par conséquent, les niveaux d'ammoniac doivent être correctement surveillés et maintenus.
Chez Hach ®, trouvez l'équipement de test, les ressources, la formation et le logiciel dont vous avez besoin pour surveiller, et gérer avec succès les niveaux d'ammoniac dans votre application de processus spécifique.
Produits associés pour la surveillance de l'ammoniac
Conçu pour une installation facile en extérieur, l'analyseur d'ammonium NH6000sc est pensé pour minimiser la maintenance, simplifier l'échantillonnage et intégrer un système de filtration léger. Obtenez des résultats de haute qualité avec un temps de réponse court.
Acheter maintenantHach propose de nombreux spectrophotomètres leaders sur le marché de l'analyse de l'eau.
Acheter en ligneLes instruments portables, robustes et faciles à utiliser de Hach sont conçus pour supporter les contraintes uniques présentes sur le terrain.
Acheter en ligneLe multimètre de laboratoire Hach HQ440D est un appareil de mesure de laboratoire avancé qui élimine les approximations des mesures.
Acheter en ligneLes appareils de mesure HQD ® se connectent aux électrodes intelligentes IntelliCAL ® qui reconnaissent automatiquement le paramètre de test.
Acheter en ligneAppareils de mesure portaif HQ Séries
L'appareil de mesure HQ Series est destiné aux professionnels du secteur de la qualité de l'eau qui souhaitent effectuer des analyses électrochimiques dans des environnements de terrain et de laboratoire.
Acheter en ligneL'analyseur en ligne Amtax sc de Hach, avec électrode sensible au gaz, est destiné à la mesure haute précision des concentrations d'ammonium directement dans le processus de traitement (installations extérieures).
Acheter en ligneAnalyseurs d'ammonium Série EZ
Les analyseurs en ligne de la série EZ fournissent plusieurs options pour mesurer la concentration d'ammonium dans l'eau.
Acheter en ligneLa sonde A-ISE sc de Hach est une sonde numérique sélective d'ions conçue pour mesurer les concentrations d'ammonium directement dans le milieu.
Acheter en ligneLe capteur combiné numérique AN-ISE sc de Hach est destiné à la mesure d'ammonium et de nitrate. Il effectue en permanence des mesures directes au moyen d'une électrode sélective d'ions.
Acheter en ligneAnalyseur portable parallèle SL1000
L'analyseur parallèle portable (PPA) Hach SL1000 réalise les mêmes tests avec moitié moins d'étapes manuelles.
Acheter en ligneHach s'engage à fournir des réactifs de haute qualité pour les analyses de routine et les analyses complexes de l'eau.
Acheter en ligne
Quels processus nécessitent une surveillance de la concentration d'ammoniac ?
Traitement de l'eau potable
L'ammoniac gazeux et ses solutions concentrées doivent être manipulés avec soin, et conformément aux exigences de l'OSHA (ou d'autres organismes de réglementation pertinents). Il possède en effet des propriétés très corrosives qui posent de sérieux risques pour la santé, allant de l'irritation légère des yeux ou de la peau à la brûlure chimique, en fonction de la concentration. En outre, l'ammoniac gazeux peut provoquer des problèmes esthétiques en altérant le goût ou l'odeur.
Lorsque l'ammoniac n'est pas utilisé pour la désinfection, sa présence dans un système de distribution peut indiquer une lixiviation des matériaux utilisés dans la tuyauterie ou une contamination de l'eau, en raison d'un endommagement du système. Lorsque l'ammoniac indésirable se combine au chlore, il diminue la force de désinfection de la chloration.
Chloramination
Dans certains procédés de désinfection, l'ammoniac est intentionnellement combiné au chlore pour produire de la monochloramine. Bien que le chlore libre soit un désinfectant plus puissant, la monochloramine (ammoniac et chlore liés) a un résidu plus fort, il reste donc dans le système de distribution plus longtemps, garantissant ainsi la désinfection jusqu'au robinet. En outre, les chloramines réagissent moins intensément avec les différentes impuretés présentes dans l'eau brute, en particulier les substances organiques, réduisant ainsi la formation de certains sous-produits de désinfection cancérigènes (DBP). Pour optimiser le processus de chloramination, il est important de surveiller la formation des espèces de désinfectants cibles, tout en empêchant la formation de dichloramine ou de trichloramine (trichlorure d'azote) moins souhaitable. Le test de monochloramine est utilisé avec une détermination de l'ammoniac libre pour assurer la formation du bon désinfectant et réduire les coûts de matières premières en empêchant la suralimentation du chlore et/ou de l'ammoniac.
En savoir plus sur la chloramination.
Ammoniac libre
L'ammoniac qui n'est pas lié au chlore pendant la désinfection par chloramination est appelé ammoniac libre (NH 4 + et NH 3). Avec un pH neutre et à température ambiante, presque tout l'ammoniac libre existe sous forme de NH 4 +. A mesure que le pH et la température augmentent, la quantité de NH 3 augmente et la quantité de NH 4 + diminue. Lorsque de l'eau chloraminée est libérée, les niveaux d'ammoniac libre augmentent à mesure que la monochloramine réagit avec divers composés organiques et bactéries dans l'eau du système de distribution, répondant à la demande de chlore. L'augmentation des niveaux d'ammoniac libre indique le début de la nitrification. Une diminution soudaine de l'ammoniac libre suggère que la nitrification est en cours et que du nitrite est en cours de formation. La valeur de l'ammoniac libre est utile pour déterminer la quantité de chlore libre nécessaire pour augmenter le résidu de monochloramine dans une station de pompage-relais. Le niveau d'ammoniac libre peut être réduit en ajoutant du chlore libre à un rapport de 5:1 sous forme de Cl 2:N pour guider le processus et réduire le potentiel de nitrification.
Ammoniac total
L'ammoniac total est la somme de tout l'azote ammoniacal présent sous forme de monochloramine (NH 2Cl), d'autres chloramines, d'ion ammonium (NH 4 +) et d'ammoniac moléculaire (NH 3). Ce paramètre peut servir de vérification primaire ou secondaire pour maintenir le processus de chloramination sous contrôle.


Traitement des eaux de surface/souterraines
L'ammoniac se forme comme sous-produit lorsque les bactéries décomposent les matériaux naturels du sol. Des concentrations élevées d'ammoniac peuvent être causées par un sol riche en fer, la proximité d'une forêt ou d'engrais, et une contamination fécale.

Traitement des eaux usées
Lors du traitement des eaux usées, la concentration d'ammoniac peut atteindre des niveaux extrêmement élevés en raison de l'action bactérienne. L'ammoniac est d'abord converti en nitrate par le processus de nitrification afin qu'il puisse être réduit en azote atmosphérique (N 2) par dénitrification. En savoir plus sur le traitement des eaux usées municipales.A des concentrations et un pH élevés, l'ammoniac peut être toxique pour les microbes de digestion des boues. De plus, pour éviter de nuire à la vie aquatique, il est essentiel de surveiller et d'éliminer l'ammoniac des effluents d'eaux usées avant qu'il ne soit rejeté dans les plans d'eau naturels.

Aquaculture
En tant que déchet de la vie aquatique, l'ammoniac peut être toxique pour les poissons et les plantes aquatiques à des concentrations faibles, dès 0,5 mg/L. Dans les aquariums établis, l'ammoniac peut être rapidement converti en nitrite et éventuellement en nitrate. La plupart des aquariums visent à éliminer complètement l'ammoniac.
Dans les environnements aquatiques naturels, des niveaux élevés d'ammoniac peuvent entraîner une croissance excessive des algues, qui bloquent la lumière du soleil, ce qui peut nuire à l'alimentation à vue et à la photosynthèse.

Agriculture
Comme les plantes ne peuvent pas fixer l'azote directement à partir de l'atmosphère, elles utilisent les bactéries fixatrices d'azote pour convertir l'azote en ammoniac. L'azote sous forme d'ammoniac peut ensuite être utilisé par les plantes pour créer d'autres molécules organiques essentielles nécessaires aux organismes complexes. Pour faciliter ou améliorer ce processus naturel (qui fait partie du cycle de l'azote), l'ammoniac est souvent ajouté aux engrais. Par exemple, les solutions nutritives hydroponiques introduisent l'azote comme sel d'ammoniac. L'ammoniac peut également être présent dans le sol en raison du dosage d'urée et de sa décomposition séquentielle.

Fabrication de produits pharmaceutiques
Dans l'industrie pharmaceutique, l'ammoniac est utilisé pour le contrôle du pH, et sa solution est utilisée pour régénérer les résines échangeuses d'ions faibles et pour l'ajustement du pH.
Comment le niveau d'ammoniac est-il surveillé ?
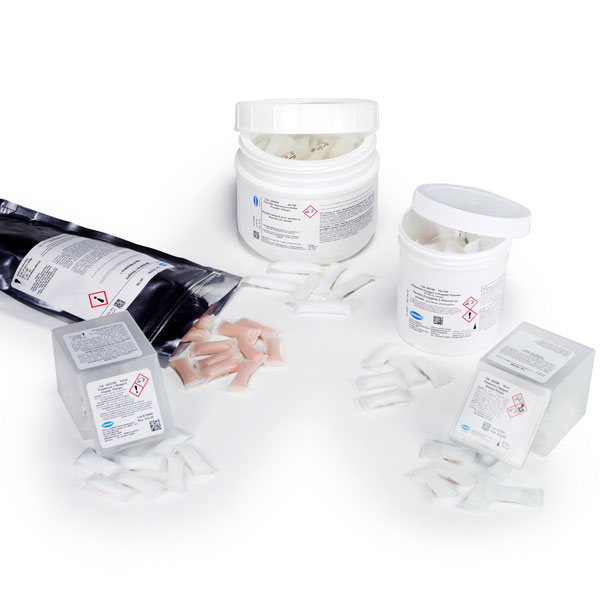
Méthode salicylate
La méthode salicylate est une variation de la méthode bien connue du phénate, mais elle a l'avantage d'être exempte de sels de mercure et de phénol. Cette méthode est particulièrement utile pour les déterminations de basses valeurs d'azote ammoniacal. Bien que la procédure implique plusieurs étapes avant le développement d'une couleur verte finale, tous les réactifs sont contenus dans des sachets de poudre pratiques (sachets de poudre de réactif salicylate et sachets de poudre de cyanurate alcalin) ou une combinaison de sachets de poudre et de tests en cuve LCK.
- Les composés d'ammoniac réagissent avec l'hypochlorite pour former de la monochloramine.
- La monochloramine réagit ensuite avec le salicylate pour former de l'acide 5-aminosalicylique.
- L'oxydation de l'acide 5-aminosalicylique est réalisée en présence d'un catalyseur, le nitroprussiate (également appelé nitroferricyanure), qui entraîne la formation d'indosalicylate, un composé bleu. La couleur bleue est masquée par la couleur jaune (provenant d'un excès de nitroprussiate), ce qui entraîne une solution de couleur verte. L'intensité du vert est directement proportionnelle à la concentration d'ammoniac dans l'échantillon.
Eaux usées ou eau dans l'environnement |
Chloramination |
|
De paillasse : Sachets de poudre méthode 8155 Portable: Bandelettes de test d'ammoniac En ligne : |
Portable: Chemkeys ammoniac libre et monochloramine DR300 monochloramine/ammoniac libre De paillasse : Spectrophotomètre DR3900 pour l'analyse de monochloramine/ammoniac libre |

Paillasse/portable :
Electrode sélective d'ions (ISE) d'ammoniac (NH3) IntelliCAL ® ISENH3181
En ligne :
Méthode Nessler
Dans le test de l'ammoniac, le réactif Nessler (K 22HgI 4) réagit avec l'ammoniac présent dans l'échantillon (dans des conditions fortement alcalines) pour produire une couleur jaune. L'intensité de la couleur est directement proportionnelle à la concentration d'ammoniac.
2K 2HgI 4 + NH 3 + 3KOH → Hg 2OINH 2 + 7KI + 2H 2O
De paillasse :
Portable :
En ligne :
Foire aux questions
Quelles méthodes peuvent être utilisées pour signaler la présence d'ammoniac dans les eaux usées à l'EPA ?
L'azote ammoniacal peut être mesuré à l'aide d'un spectrophotomètre (ou d'un colorimètre) ou d'une électrode sélective d'ions d'ammoniac (ISE). Les méthodes indiquées ci-dessous sont acceptées ou équivalentes aux méthodes de l'Agence américaine de protection de l'environnement (USEPA) pour l'analyse des eaux usées.
Méthode Nessler azote-ammoniac 8038 - acceptée par l'USEPA pour l'analyse des eaux usées (distillation requise), méthode 350.2.
Méthode électrode sélective d'ions (ISE) pour l'ammoniac d'azote 10001 et 10002 - ces procédures peuvent être utilisées pour les méthodes standard d'examen de l'eau et des eaux usées 4500-NH3 E pour le rapport NPDES USEPA.
Pourquoi les réactifs de salicylate d'ammoniac LCK sont-ils équivalents à l'EPA, mais les réactifs de salicylate d'Amver TNT ne le sont pas ?
Les tests en cuve LCK pour l'ammoniac LKC303, LKC304, LKC305 sont considérés comme équivalents pour l'analyse et la déclaration des eaux usées par l'Agence américaine pour la protection de l'environnement (USEPA). Les kits de réactifs d'ammoniac TNT Amver ne sont pas considérés comme équivalents pour la déclaration USEPA.
Hach a créé une méthode formatée EPA avec des données de support côte à côte pour respecter le MUR et l'équivalence d'état pour les réactifs de salicylate d'ammoniac LCK. Ceci n'a pas été fait pour les anciens réactifs de salicylate TNT Amver. Si un utilisateur souhaite envisager la conformité aux réglementations des anciens tests d'ammoniac TNT, il peut toujours en discuter avec son autorité de réglementation.
Pour plus d'informations sur l'équivalence USEPA aux normes 350.1 et 351.1, se reporter à la méthode formatée EPA, « LCK Ammonia-Spectrophotometric Measurement of Ammonia Nitrogen and Total Kjeldahl Nitrogen in Water and Wastewater ».
Les méthodes Nessler et salicylate détectent-elles l'ammoniac ou l'ammonium ?
Les deux méthodes sont basées sur une réaction avec l'ammoniac moléculaire dans une solution basique. Si l'échantillon d'origine contenait des ions d'ammonium, les réactifs de base les convertiraient en ammoniac moléculaire, qui réagissent et contribuent au résultat final du test. Cependant, ces tests simples sur l'ammoniac n'incluent pas l'ammoniac qui se trouve dans les groupes amino liés organiquement. Un véritable test de l'ammoniac total inclurait des chloramines et nécessiterait le chauffage de l'échantillon dans une solution acide pour digérer l'ammoniac organique.
Comme le résultat du test est une somme d'ammoniac moléculaire (NH 3) et d'ammonium ionique (NH 4 +), l'unité préférée pour la déclaration est l'azote (NH 3 -N). La plupart des colorimètres et spectrophotomètres Hach ont la possibilité de convertir les résultats de test entre l'azote, l'ammoniac et l'ammonium. Cela ne modifie pas le constituant chimique du test ; uniquement les unités. Il convient de noter que, bien qu'il y ait la même quantité d'azote dans l'ammoniac et l'ammonium, le rapport stœchiométrique de N à NH 3 et NH 4 + ne sont pas exactement égaux en raison du nombre différent d'atomes d'hydrogène.
- Pour passer des mg/L NH 3 -N aux mg/L NH 3, multipliez par 1,216.
- Calculé à partir de la masse de NH 3 divisée par la masse de N (17,034 ÷ 14,01 = 1,216)..
- Pour passer des mg/L NH 3 -N aux mg/L NH 4, multipliez par 1,288.
- Calculé à partir de la masse de NH 4 + divisée par la masse de N (18,042 ÷ 14,01 = 1,288).
Que mesure réellement l'analyseur Amtax sc ?
Lorsque la mesure est affichée sur l'Amtax sc, les unités sont « NH 4 -N » ou « NH 4», ce qui signifie que la mesure de l'instrument est exprimée en ammonium et rapporte les valeurs sous forme d'azote (également décrit comme « NH 4 comme N ») ou d'ammonium. Il n'y a pas de différence entre l'expression de la concentration d'ammoniac (« NH 4 -N » ou « NH 3 -N »), car dans les deux cas, elle est calculée comme de l'azote, dont la quantité est identique dans les deux formes d'ammoniac.
L'analyseur Amtax sc ajoute de l'hydroxyde de sodium (NaOH) pour ajuster le pH et convertir les ions d'ammonium (NH 4 +) en ammoniac gazeux (NH 3), qui traverse une membrane sélective de gaz ammoniac et provoque une modification du pH d'une solution électrolytique. Ce changement de pH dans l'électrolyte est mesuré sous forme de signal mV proportionnel à la concentration d'ammoniac (NH 3) dans l'échantillon.
Quelle concentration d'ammoniac est toxique pour les poissons ?
L'ammoniac existe dans l'eau sous forme d'ion ammonium (NH 4 -) ou d'ammoniac non ionisé (NH 3). L'ammoniac non ionisé est toxique pour les poissons, tandis que les ions d'ammonium sont uniquement toxiques dans des concentrations extrêmement élevées. A un pH neutre de 7 et à température ambiante, presque tout l'ammoniac existe sous la forme NH4+. A mesure que le pH et la température augmentent, la quantité de NH 3 augmente et la quantité de NH 4 + diminue.
Pour mesurer la concentration d'ammoniac non ionisé dans un échantillon, procédez comme suit :
- Mesurez la concentration d'ammoniac à l'aide de toute méthode de calcul de l'ammoniac, à l'exception du calcul de l'ammoniac libre.
- Mesurez le pH et la température de l'échantillon. Reportez-vous au tableau intitulé « Percentage Un-ionized Ammonia in Aqueous Solution by pH Value and Temperature Calculated from data in Emerson, et. al* », à la page 11 du manuel FF2 Freshwater Aquaculture Test Kit.
- Déterminez le pourcentage de NH 3 en vous référant au tableau, au pH de l'échantillon et à la température de l'échantillon.
- Multipliez votre concentration d'ammoniac par le pourcentage du tableau, puis divisez par 100.